
توضیح جامع روش PCR-RFLP از مرحله انتخاب SNP، طراحی پرایمر، انتخاب آنزیم و آنالیزآماری داده ها
1-1-آموزش مقدماتی روش PCR-RFLP
تکنیک PCR-RFLP با نام کامل Polymerase chain reaction-restriction fragment length polymorphism به معنی تشخصی وجود پلی مورفیسم ها مخصوصا تغییرات تک نوکلئوتیدی (SNP) در ژنوم به وسیله آنزیمهای محدودگر میباشد. قبل از توضیحات بیشتر در مورد تکنیک PCR-RFLP ، در مورد اهمیت و کاربرد شناسایی جهشها در ژنوم توضیحاتی را ارائه میدهیم، زیرا یک از کاربردهای بسیار مهم تکنیک PCR-RFLP تشخصی جهشها میباشد و اصولاً توضیح یک تکنیک بدون توضیح کاربردهای آن، آموزشی ناکامل میباشد. پس در ادامه توضیحاتی در مورد کاربرد شناسایی جهشها در ژنوم ارائه میدهیم و سپس تکنیک PCR-RFLP را به صورت کامل مورد بحث قرار میدهیم. در توضیحات زیر فقط به کاربرد شناسایی جهشها در ژنوم توجه نمایید نه آموزش تکنیک PCR-RFLP.
معرفی چند اصطلاح:
آنزیم محدودگر: آنزیمی که با شناسایی توالی خاصی بر روی DNA و یا RNA اقدام به برش آن قطعه مینماید.
جهش: هر گونه تغییر پایدار در توالی DNA را جهش گویند.
SNP: در صورتی که یک جهش تنها سبب تغییر در یک نوکلئوتید شود به آن SNP میگویند.
پلی مورفیسم: در صورتی که فراوانی یک جهش در جامعه بیشتر از 1% باشد با آن جهش پلی مورفیسم میگویند.
ژن: توالیای از ژنوم که یک محصول عملکردی را کد مینماید.
الل: به حالتهای مختلف یک ژن الل میگویند. به عنوان مثال ژن رنگ مو میتواند دارای الل رنگ مشکی، الل رنگ قرمز و الل رنگ سفید باشد. در هنگام بروز جهش در یک ژن ما دارای دو الل هستیم: الل دارای جهش و الل فاقد جهش
واریانت (transcription variant): به mRNAهای مختلفی که از یک ژن به دلیل اسپلایسنگ های مختلف ایجاد میشود، واریانت میگویند. پس توالی واریانت های مختلف از یک توالی مشترک کد نویسی میگردد و سپس در توالی آنها تغییراتی حاصل میشود.
فنوتیپ: صفاتی که در افراد مشاهده میگردد مانند بیماری، سرطان، رنگ مو و ….
1-2- اهمیت بررسی جهشها در ژنوم
چرا باید جهشها (تغییرات تک نوکلئوتیدی (SNP) و پلی مورفیسم ها در ژنوم) را مورد بررسی قرار دهیم؟ مشخصشده است که ژنوم موجودات به طور طبیعی دارای تفاوتهایی در ردیف بازهای خطی میباشند، این تغییرات طبیعی که سبب گوناگونی در افراد یک جمعیت میشود چند شکلی ژنتیکی (پلی مورفیسم یا جهش) نام دارد. جهشها از طرق مختلفی میتوانند سبب تغییر در فنوتیپ اصلی و بروز صفات جدید مانند بیماری یا سرطان گردند. در این بخش قصد داریم به صورت کاربردی اهمیت شناسایی ارتباط جهشها بروز صفات را توضیح دهیم.
به بررسیهای شناسایی ارتباط جهشها با بروز یک فنوتیپ خاص مطالعات همبستگی “association study” میگویند.
از این گونه بررسیها به فراوانی در پایاننامه دانشجویان رشتههای زیستشناسی به خصوص در دوره ارشد استفاده میگردد. اما association study چیست: قبل از توضیح بررسی ارتباط (association ) جهشها با بروز یک صفت خاص، به یک مثال غیر ژنتیکی شناخته شده توجه نمایید: “مصرف سیگار باعث افزایش بروز سرطان ریه میگردد (یعنی مصرف سیگار دارای association با بروز سرطان ریه میباشد)” در این مثال افرادی که سیگار استعمال مینمایند دارای ریسک بالاتری برای ابتلا به سرطان ریه میباشند، پس شناسایی سیگار بهعنوان یکی از ریسک فاکتورهای سرطان ریه دارای اهمیت میباشد. جهشهای ژنتیکی نیز دقیقاً شبیه مثال فوق میباشند، و افرادی که داری یک سری جهشهای خاصی میباشند دارای ریسک بالاتری برای ابتلا به سرطان ریه میباشند. یافتن این جهشها از طریق تکنیک PCR-RFLP و تعیین سطح خطر افراد دارای این جهشها، موضوع بسیاری از پایاننامهها و طرحهای پژوهشی در کشورمان میباشد. حال چگونه میتوان پی برد که یک جهش با بروز یک صفت مانند سرطان ریه مرتبط میباشد. در مثال ارتباط سیگار با بروز سرطان ریه، ما انتظار داریم که افراد دارای سرطان نسبت به افراد فاقد سرطان، سیگار بیشتری مصرف نمایند به عبارت دیگر درصد افراد سیگاری در افراد سرطانی بیشتر باشد. بنابراین اگر ما 200 فرد مبتلا به سرطان ریه و 200 فرد فاقد سرطان را که به صورت تصادفی انتخاب نماییم و سپس میزان مصرف سیگار را در افراد دو گروه بررسی نماییم و درصد افراد سیگاری در دو گروه را با روشهای آماری موردبررسی قرار دهیم، انتظار داریم که در صد افراد سیگاری در گروه افراد سرطانی بیشتر از افراد غیر سرطانی باشد. همین اصول در طراحی پروژههای ژنتیکی نیز به کار میرود، به این صورت که ابتدا با بررسی مقالات یک جهش که احتمالاً با یک صفت مرتبط میباشد انتخاب میگردد، در مرحله بعد بهصورت تصادفی دو گروه از افراد (یک گروه دارای صفت موردنظر و یک گروه افراد فاقد صفت موردنظر) انتخاب میگردند، در مرحله بعد درصد و فراوانی جهش در دو گروه با تکنیکهایی مانند PCR-RFLP مشخص میگردد و در مرحله آخر با آزمونهای آماری معنیدار بودن فراوانی جهشها در دو گروه موردبررسی قرار میگیرد. در این کتاب کلیه مراحل فوق را بهصورت دقیق مورد آموزش قرار خواهیم داد.
حال که به اهمیت شناسایی جهشها در ژنوم آشنا شدید، تکنیک PCR-RFLP را که یکی از روشهای شناسایی جهش میباشد موردبررسی قرار میدهیم. قبلاً اشاره نمودیم که تکنیک PCR-RFLP به معنی تشخیص وجود تغییرات تک نوکلئوتیدی (SNP) و پلی مورفیسم ها در ژنوم به وسیله آنزیمهای محدودگر میباشد و همچنین اشاره نمودیم که جهش به معنی تغییر در توالی ژنوم میباشد. حال این دو مفهوم را با هم ترکیب نماییم: اگر یک جهش سبب ایجاد یک جایگاه شناسایی برای یک آنزیم محدود گردد و یا برعکس اگر یک جهش سبب از بین رفتن یک جایگاه شناسایی آنزیمی گردد، بنابراین میتوانیم از طریق هضم شدن یک قطعه توسط آنزیم مربوطه وجود یا عدم وجود آن جهش را موردبررسی قرار دهیم. به شکل شماره یک توجه نمایید. در قسمت A دو توالی قابل مشاهده میباشد. توالی بالا توالی فاقد جهش میباشد و توالی دوم دارای یک جهش از T به A میباشد که این جهش سبب ایجاد یک جایگاه برش برای آنزیم ECORI در توالی میگردد.( N به معنی وجود هر نوع باز میباشد). حال با استفاده از تکنیک PCR-RFLP میخواهیم این دو توالی را از هم جدا تفکیک نماییم، به دلیل اینکه دو توالی فوق تنها در جایگاه برش آنزیم ECORI با هم تفاوت دارند بنابراین با تیمار کردن دو توالی با آنزیم ECORI، تنها توالی جهش یافته برش خواهد خورد و به دو قطعه کوچکتر تبدیل خواهد شد (شکل 1 قسمت B). در مرحله بعد میتوان توالی برش خورده و توالی برش نخورده را بر روی ژل الکتروفورز از هم تفکیک نمود (قسمت C).
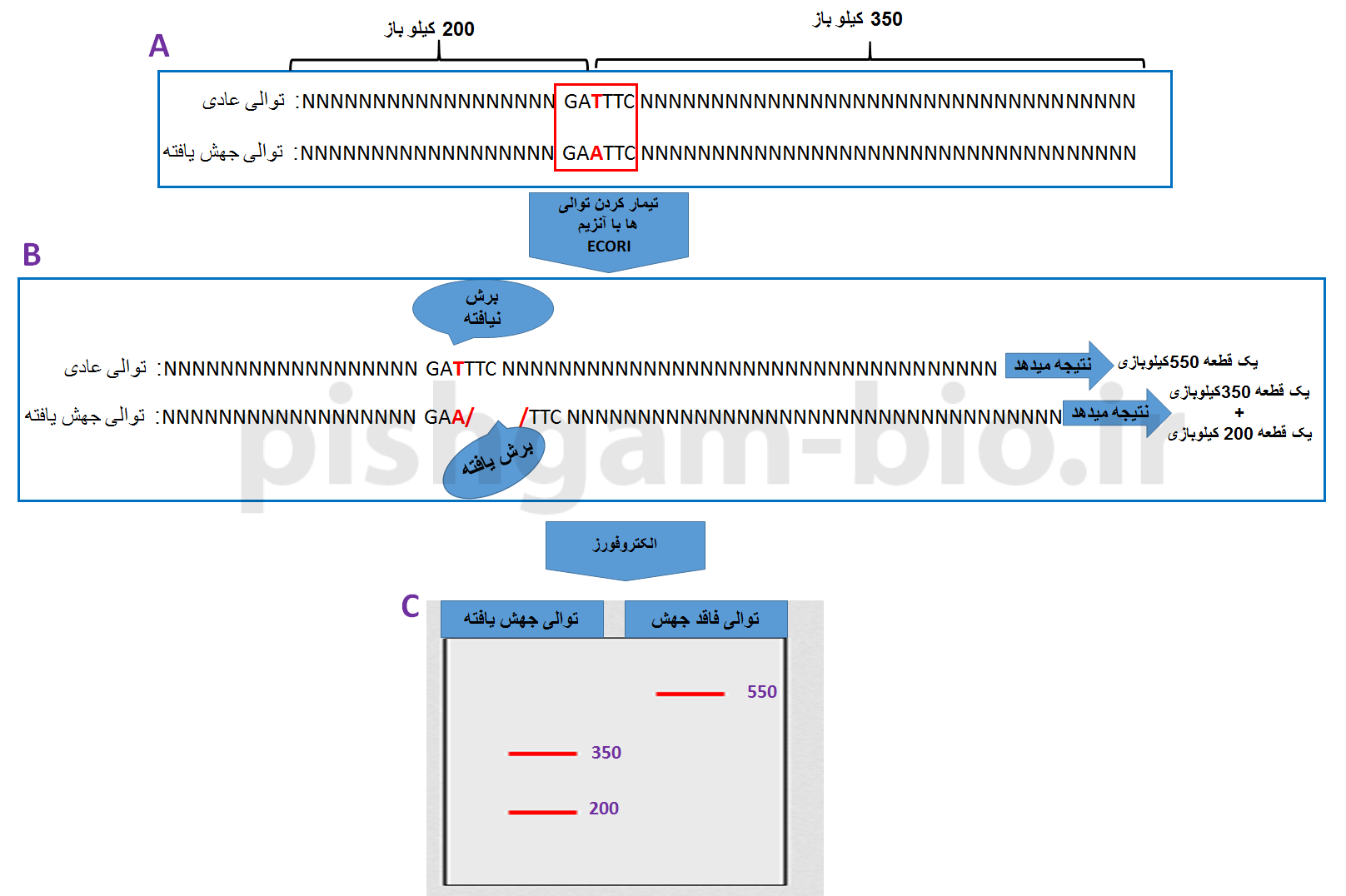
شکل 1: اصول تکنیک PCR-RFLP در شناسایی جهشها
1-3- تفاوت روش RFLP با PCR-RFLP(PBR):
در روشRFLP ابتدا نمونهای ازDNAرا با یك نوع آنزیم برشی، هضم میكنند (شکل 2 قسمت A) كه درنتیجه تعداد زیادی قطعه با طول متفاوت به دست میآید، سپس این قطعات با استفاده از ژل پلی اکریل آمید از همدیگر جدا میشوند(شکل 2 قسمت B). و سپس برای شناسایی و تشخیص یك قطعه خاص باید همه قطعات بهوسیله تکنیک لکهگذاری سادرن بر روی غشا منتقل شوند و سپس با استفاده از پروب های اختصاصی قطعه موردنظر را پیدا مینمایند(شکل 2 قسمت C). این روش بسیار هزینهبر و نیاز به بهینه سازی دارد و دارای دقت کمتری میباشد. شکل 2 مراحل RFLP را نشان میدهد. تو جه داشته باشید که در روش RFLP برای توالیای که برش میخورد تنها یک قطعه (از دو قطعه) که کوچکتر از توالی برش نخورده میباشد قابل مشاهده میباشد. به دلیل اینکه پروب تنها به یک قطعه متصل میگردد به همین دلیل در شکل 2 قسمت C تنها یک قطعه برای فرد عادی و جود دارد.
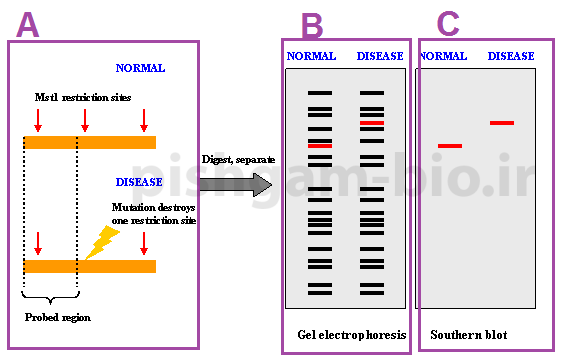
شکل شماره 2: نحوه انجام RFLP
در روش PCR-RFLP ، ابتدا قطعه حاوی جهش (همچنین قطعه فاقد جهش) را با واكنش زنجیرهِ پلیمراز و استفاده از دو پرایمر مخصوص كه به همین منظور طراحی شده تكثیر مینمایند(شکل 3 قسمت A) و پس از هضم آنزیمی (شکل 3 قسمت B و C) ، الكتروفوز میكنند(شکل 3 قسمت D). شکل 3 نحوه انجام PCR-RFLP را نشان میدهد.
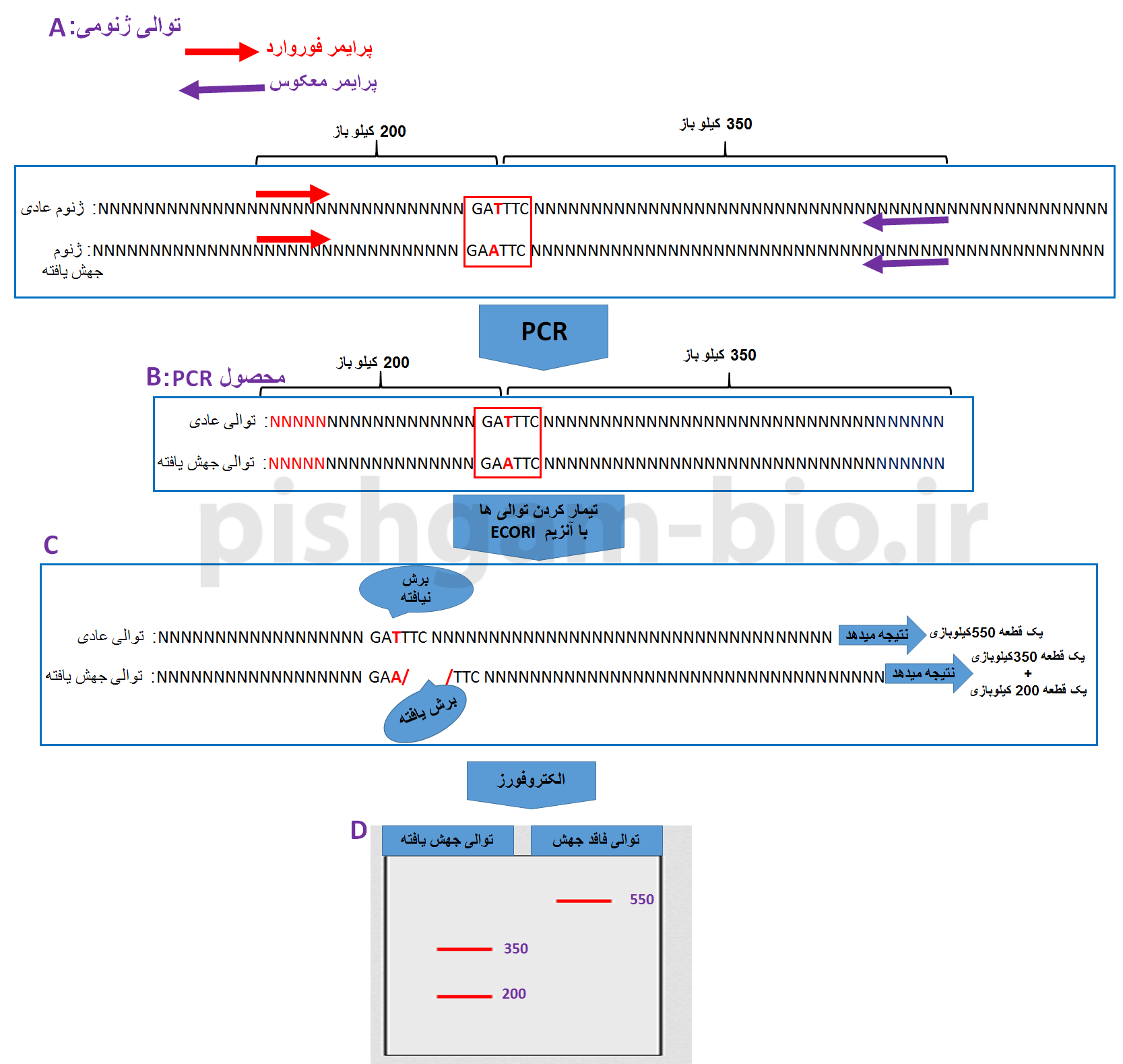
شکل شماره 3: نحوه انجام PCR-RFLP
در RFLPسادرن تنوع DNAدر داخل یك منطقه Kb 30محصور توسط پروب تعیین میگردد در حالی كه در PCR-RFLP تنوع در داخل منطقهای كه از دو طرف به پرایمر ختم شده تعیین میشود این ناحیه معمولا Kb2-0.5 است. علاوه بر این در PCR-RFLP مزایایی چون سادگی، سرعت زیاد، عدم نیاز به مواد رادیواكتیو تكرارپذیری بالا مطرح میباشد. به همین دلیل در اکثر آزمایشگاههای درون کشور از روش PCR-RFLP استفاده میگردد.
1-4- شناسایی ژنوتیپ ها به وسیله روش PCR-RFLP
در توضیحاتی که در قسمت بالا برای تکنیک PCR-RFLP ارائه شده برای سادگی کار تنها از یک توالی حاوی جهش و یک توالی فاقد جهش استفاده گردید. در مثالهای فوق توالیهای مثال ارائه شده، بیانگر ژنوم یک موجود هاپلوئید میباشد و در موجودات هاپلوئید برای هر ژن تنها یک نسخه وجود دارد و به عبارتی الل ها بیانگر ژنوتیپ ها میباشند، پس موجودات هاپلوئید دارای یک الل میباشند که این الل میتواند دارای توالی جهش یافته و یا توالی غیر جهش یافته باشد، بنابراین برای موجودات هاپلوئید تنها دو ژنوتیپ داریم:
حالت اول: ژنوتیپ دارای یک الل جهش یافته (موتانت).
حالت دوم: ژنوتیپ دارای الل سالم (وحشی).
اما موجودات دیپلوئید مثل انسان دارای دو الل از هر ژن میباشند پس برای انسان، سه ژنوتیپ (و دو الل) داریم. هر انسانی دارای یکی از سه ژنوتیپ زیر میباشد:
1.حالت اول: ژنوتیپ دارای دو الل جهش یافته (هموزیگوت موتانت).
2. حالت دوم: ژنوتیپ دارای دو الل سالم (هموزیگوت وحشی).
3. حالت سوم: ژنوتیپ دارای یک الل سالم و یک الل جهش یافته (هتروزیگوت).
حال فرض کنیم که الل جهش یافته (موتانت) به وسیله آنزیم ECORI برش میخورد بنابراین تعداد باندهایی که برای هر ژنوتیپ در انسان قابل مشاهده میباشد را در شکلهای 4 و 5 میتوان مشاهده نمود.

شکل شماره 4: باندهای حاصل از PCR-RFLP برای ژنوتیپ های مختلف یک موجود دیپلوئید. در این شکل الل جهش یافته دارای محل برش برای آنزیم محدودگر میباشد.
نکته: در تکنیک PCR-RFLP شناسایی افراد هتروزیگوت نسبت افراد هموزیگوت، این تکنیک را به یک روش قدرتمند در بررسی روابط فیلوژنتیکی تبدیل نموده است.
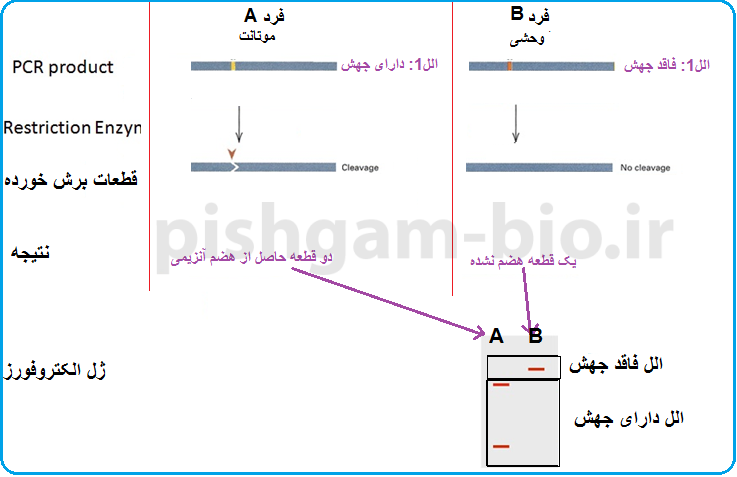
شکل شماره 5: باندهای حاصل از PCR-RFLP برای ژنوتیپ های مختلف یک موجود هاپلوئید. در این شکل الل جهش یافته دارای محل برش برای آنزیم محدودگر میباشد.
تعریف اصطلاحات:
الل وحشی: اللی که در آن جهشی وجود ندارد
الل موتانت: اللی که در آن جهش رخ داده است..
1-5- مزایای PCR-RFLP عبارت از موارد زیر میباشد
– تحت تأثیر محیط نیست و صد در صد ژنتیكی است
– هم بارز است (ژنوتیپ هتروزیگوت در آن قابل تشخیص است)
– تکرارپذیری آن بالاست
-هزینه پایین
-عدم نیاز به تکنولوژی بالا
-بهینه سازی سریع
-آنالیز آسان نتایج
1-5- نحوه طراحی یک پروژه بر اساس تکنیک PCR-RFLP
تا این قسمت مقدمات تکنیک PCR-RFLP را توضیح دادیم، اکنون برای آموزش کاربردی و پیشرفته این تکنیک، اصول طراحی پک پروژه بر اساس این تکنیک را مطرح مینماییم و به آموزش مراحل آن میپردازیم. اکنون میخواهیم پروژهای را مطرح نماییم که در آن ارتباط یک جهش را با بروز یک فنوتیپ مانند سرطان ریه مورد بررسی قرار دهیم. مراحل اجرای این پروژه بهصورت زیر میباشد:
انتخاب جهش (پلی مورفیسم) مناسب: در این بخش موارد زیر آموزش داده خواهد شد:
نحوه دریافت توالی یک ژن در ناحیه کدینگ، اینترون ها و پروموتر
نحوه شناسایی جهشهای موجود بر روی توالی یک ژن به تفکیک ناحیه کدینگ، اینترون ها و پروموتر
آشنایی با ویژگیهایی که یک جهش را برای بررسی با تکنیک PCR-RFLP مناسب میسازد.
شناخت جهشهایی که نمیتوان آنها را روش PCR-RFLP موردبررسی قرارداد.
شناسایی جهشهایی که در محل اتصال فاکتورهای رونویسی پروموتر رخ میدهد.
شناسایی جهشهایی که در محل اتصال و تنظیمی میکروارناها به ژن رخ میدهد.
انتخاب آنزیم محدودگر مناسب: در این بخش موارد زیر آموزش داده خواهد شد:
شناسایی جایگاههای شناسایی آنزیمهای محدودگر بر روی یک قطعه
آشنایی با ویژگیهای یک آنزیم محدودگر مناسب
آشنایی با آنزیمهایی که از آنها نمیتوان در تکنیک PCR-RFLP مورد استفاده قرارداد.
طراحی پرایمر برای واکنش PCR-RFLP:
آموزش اصول طراحی پرایمر اصولی برای تکنیک PCR-RFLP با نرمافزارهای مختلف
هماهنگ نمودن پرایمرها با جایگاههای شناسایی آنزیمها
بررسی اختصاصیت و کیفیت پرایمر های طراحی شده
تعیین حجم نمونه مناسب برای بررسی:
آشنایی با محاسبه تعداد نمونه لازم برای بررسی با فرمولهای آماری
آشنایی با تعیین میزان قدرت (power) نمونهگیری در مطالعه
آنالیز آماری دادههای PCR-RFLP:
آنالیز دادههای حاصل از PCR-RFLP در مطالعات همبستگی از طریق نرمافزار SPSS
مقایسه متغیرهای زمینهای مانند سن و جنسیت بین دو گروه شاهد و Case
بررسی فراوانی و معنی داری ژنوتیپ های یک جهش در مطالعات همبستگی موردی شاهدی
بررسی ارتباط ژنوتیپ ها با بروز یک فنوتیپ در مطالعات موردی شاهدی برحسب جنسیت
محاسبه فراوانی الل ها و بررسی معنی داری آنها در مطالعات همبستگی موردی شاهدی
محاسبه odds ratio، 95%CI و p value به وسیله رگرسیون لجستیک
محاسبه odds ratio، 95%CI و p value به وسیله آزمون کای مربع
بررسی معنیداری مدلهای غالب، مغلوب و هم بارز در مطالعات همبستگی موردی شاهدی
آموزش محاسبه سطح معنیداری تصحیح شده ( adjusted p-value)
محاسبه تعادل هاردی واینبرگ در جمعیت
محاسبه ژنوتیپ کلی و معنی داری آن در مطالعات همبستگی موردی شاهدی
آنالیز دادههای حاصل از PCR-RFLP در مطالعات همبستگی از طریق نرمافزار SNP Analyzer 2
بررسی آماری پلی مورفیسم ها در مطالعات همبستگی موردی شاهدی با SNP Analyzer 2
محاسبه فراوانی هاپلوتایپ ها و بررسی آماری آنها به وسیله نرمافزار SNP Analyzer 2
محاسبه لینکاژ بین جهشها بهوسیله نرمافزار SNP Analyzer 2
پایان بخش اول (مقدمه)
فهرست آموزش بخش های مرتبط با روش PCR-RFLP
بخش اول: مقدمه
1-1-آموزش مقدماتی روش PCR-RFLP
1-2- اهمیت بررسی جهش ها در ژنوم
1-3-تفاوت روش RFLP با PCR-RFLP(PBR):
1-4- شناسایی ژنوتیپ ها به وسیله روش PCR-RFLP
1-6- نحوه طراحی یک پروژه بر اساس تکنیک PCR-RFLP
بخش دوم: انتخاب جهش (پلی مورفیسم) مناسب برای تکنیک PCR-RFLP
1-1-ویژگیهای یک جهش مناسب در بررسی های همبستگی موردی-شاهدی
بخش سوم: دریافت توالی یک ژن در سایت NCBI
3-1- آموزش مقدماتی سایت NCBI برای دریافت توالی یک ژن
3-2- آموزش دریافت مشخصات و توالی یک واریانت از یک ژن در سایت NCBI
3-3- آموزش دریافت توالی کامل یک ژن در سایت NCBI
3-4-آموزش نحوه یافتن جهشهای یک ژن در سایت NCBI
3-5- تعیین فراوانی الل های حاصل از یک جهش در پروژه 1000 ژنوم.
بخش چهارم: انتخاب آنزیم محدودگر مناسب برای تکنیک PCR-RFLP
4-1-یافتن آنزیمهای محدودگر برای یک توالی
4-2- ویژگیهای یک آنزیم محدودگر مناسب برای تکنیک PCR-RFLP
بخش پنجم: آموزش شناسایی توالی مرکزی پروموتر در ژنها و یافتن جهش های موجود در آن ها
5-1- اهمیت بررسی جهش ها در بخش پروموتر
5-2-آشنایی با پایگاه داده UCSC جهت بافتن توالی مرکزی یک پروموتر
5-3-شناسایی فاکتورهای رونویسی متصل شوند به پروموتر و جایگاه اتصال آنها
5-3-1-آموزش سایت PROMO جهت شناسایی فاکتورهای رونویسی متصل شونده به توالی پروموتر
بخش ششم: شناسایی جهش های موجود در نواحی اتصالی میکروRNAها به ژن ها
6-1- مقدمه ای در مورد میکروRNAها و اهمیت بررسی جهش ها در آن ها
6-2-آشنایی با پایگاه mirbase
6-3- روشهای شناسایی اهداف میکروRNA ها
6-3-1- نرمافزار Miranda
6-3-2-نرم افزار Diana-microT
6-3-3-آشنایی با سایت mirmap برای شناسایی میکروRNAهای تنظیم کننده یک ژن
6-3-4-آشنایی با سایت Target Scan برای شناسایی میکروRNAهای تنظیم کننده یک ژن
6-3-5-آشنایی با وب سایت Mirwalk برای شناسایی میکروRNAهای تنظیم کننده یک ژن
6-3-6- آموزش نرمافزار RNA hybrid برای شناسایی میکروRNAهای تنظیم کننده یک ژن
بخش هفتم: طراحی پرایمر برای واکنش PCR-RFLP
7-1- نکات اختصاصی طراحی پرایمر برای روش PCR-RFLP
7-2- نکات عمومی طراحی پرایمر در روش PCR-RFLP
7-3-آموزش نرمافزار oligo 7 برای طراحی پرایمر
7-3-1- وارد نمودن توالی در نرمافزار Oligo 7
7-3-2-آشنایی با نرمافزار oligo 7 و طراحی پرایمر به صورت دستی در نرمافزار
7-3-3-بررسی تطابق پرایمرهای بررسی شده با آنریم محدودگر
7-4آموزش طراحی پرایمر با نرمافزار آنلاین پرایمر 3 ( Primer3 )
7-5- بررسی پرایمرها با استفاده از نرمافزار Oligo analyzer (IDT)
7-6-بررسی اختصاصی بودن پرایمرهای طراحی شده از طریق سایت NCBI
بخش هشتم: آموزش آنالیز آماری داده های حاصل از روش PCR-RFLP در مطالعات همبستگی
8-1- آنالیز داده های حاصل از PCR-RFLP در مطالعات همبستگی از طریق نرم افزار SPSS
8-1-1-نحوه آمادهسازی دادههای مارکر PCR-RFLP برای آنالیز آماری
8-1-2-وارد نمودن دادهها در نرمافزار SPSS
8-1-3- آنالیز دادههای حاصل از پلی مورفیسم ها در نرم افزار SPSS
8-1-4-مقایسه متغیر سن بین دو گروه شاهد و Case بهوسیله آزمون من ویتنی
8-1-5-بررسی متغیر سن بین دو گروه شاهد و case به وسیله آزمون T
8-1-6-مقایسه متغیر جنسیت در دو گروه شاهد و case
8-1-7-بررسی فراوانی و معنی داری ژنوتیپ های یک جهش در مطالعات همبستگی موردی شاهدی
8-1-8-بررسی ارتباط ژنوتیپ ها با بروز یک فنوتیپ در مطالعات موردی شاهدی برحسب جنسیت
8-1-9-محاسبه فراوانی الل ها و بررسی معنی داری آن ها در مطالعات همبستگی موردی شاهدی
8-1-10-محاسبه odds ratio، 95%CI و p value بهوسیله رگرسیون لجستیک
8-1-11-بررسی معنیداری مدلهای غالب، مغلوب و هم بارز در مطالعات همبستگی موردی شاهدی
8-1-12-آموزش محاسبه سطح معنیداری تصحیح شده ( adjusted p-value)
8-1-13- محاسبه تعادل هاردی واینبرگ در جمعیت
8-1-14-محاسبه ژنوتیپ کلی و معنی داری آن در مطالعات همبستگی موردی شاهدی
8-2-آنالیز داده های حاصل از PCR-RFLP در مطالعات همبستگی از طریق نرم افزار SNP Analyzer 2
8-2-1-مقدمات نرم افزار SNP Analyzer 2 و نحوه وارد نمودن داده ها در این نرم افزار
8-2-2- بررسی آماری پلی مورفیسم ها در مطالعات همبستگی موردی شاهدی با SNP Analyzer 2
8-2-3-محاسبه فراوانی هاپلوتایپ ها به وسیله نرمافزار SNP Analyzer 2
8-2-4-بررسی آماری هاپلوتایپ ها در مطالعات مورد شاهدی بهوسیله نرمافزار SNP Analyzer 2
8-2-5-محاسبه لینکاژ بین جهشها بوسیله نرم افزار SNP Analyzer 2
بخش نهم: محاسبه حجم نمونه در مطالعات موردی شاهدی












دیدگاهتان را بنویسید