پردازش واصلاح نمودن داده ها ریل تایم براساس کنترل های no-RT
همان گونه که قبلا توضیح دادیم کنترل های no-RT یکی از کنترل های مهم در بررسی کیفیت داده های ریل تایم می باشد و همچین توضیح دادیم که اختلاف نمونه های RT+ با نمونه های No-RT نباید از 2 سی تی کمتر باشد. وجود Ct پایین برای نمونه های No-RT می تواند دلیل آلودگی DNA و یا وجود پرایمر دایمر در واکنش ریل تایم باشد. از آنجایی که آلودگی DNA و دایمر پرایمر می تواند سبب تغییر Ct نمونه های RT+ گردد و به عنوان مثال نمونه ای که آلوده به DNA می باشد می تواند دارای Ct پایین تر نسبت به نمونه های فاقد آلودگی باشد، بنابراین اثر آلودگی DNA و دایمر پرایمر بر روی Ct نمونه های RT+ باید اصلاح شود.
اصلاح و پردازش داده های ریل تایم با میزان RNA استفاده شده در سنتز cDNA
یکی از شرایط مهم در سنتز cDNA برای نمونه ها این است که میزان RNA استفاده شده برای همه نمونه ها برابر باشد. افزایش میزان RNA می تواند سبب افزایش تعداد رشته های الگو در واکنش ریل تایم و در نتیجه کاهش Ct آن نمونه گردد. البته در صورتی که از ژن رفرنس نیز در کنار ژن های هدف به عنوان نرمال کننده استفاده شود میزان dCt محاسبه شده برای cDNAهای سنتز شده با RNAها با غلظت متفاوت برای یک نمونه یکسان خواهد بود. اما در شرایطی که از ژن رفرنس در ریل تایم استفاده نمی شود و یا درصورت تمایل می توان داده های ریل تایم را با میزان RNA استفاده شده در سنتز cDNA اصلاح نمود. استفاده از میزان RNA استفاده شده در سنتز cDNA برای اصلاح داده های ریل تایم دارای یک شرط می باشد: حجم cDNA نهایی و میزان رقیق نمودن آن و میزان استفاده از cDNA در واکنش ریل تایم برای همه نمونه ها برابر باشد. به عنوان مثال اگر برای نمونه اول با 500 نانوگرم RNA 20 میکرولیتر cDNA سنتز شود و این cDNA به نسبت 1 به 5 رقیق شود و از 1 میکرو لیترآن به عنوان الگو در ریل تایم استفاده شود در صورتی که نمونه دوم با 250 نانوگرم RNA 10 میکرولیتر cDNA سنتز شود و با شرایط 1 به 5 رقیق شود دیگر نمی توان از میزان RNA استفاده شده در سنتز cDNA برای اصلاح داده های ریل تایم استفاده نمود.
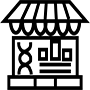
آموزش پردازش داده های ریل تایم با استفاده از Spike
Spike الگوهای RNA سنتزی با غلظت های مشخص می باشد. بعد از استخراج RNA و هنگام سنتز cDNA میزان یکسانی از RNAهای spike را به همه نمونه ها اضافه می نمایند و سپس سنتز cDNA انجام می پذیرد برای رشته های spike نیز پرایمر طراحی شده است و از آن ها در واکنش ریل تایم استفاده می شود. در واقع برای هر نمونه علاوه بر محاسبه Ct ژن رفرنس و ژن هدف، برای spike نیز Ct محاسبه می شود. به دلیل اینکه میزان RNAهای spike برای همه نمونه ها یکسان می باشد میزان Ct محاسبه شده در همه نمونه ها برای spike نیز باید برابر باشد. در واقع spike مشخص کننده کیفیت سنتز cDNA می باشد. اگر Ct گزارش شده برای Spike بالا باشد در نتیجه مراحل سنتز cDNA برای آن نمونه دارای مشکل می باشد.
پردازش داده های تکرار تکنیکال برای ریل تایم
تکرار تکنینال برای بررسی صحت مراحل کار مانند استخراج RNA، سنتز cDNA و ریل تایم ضروری می باشد. اما هنگامی که می خواهیم داده های دو تکرار ریل تایم که در دو ریل تایم مجزا اجرا شده است را با هم ادغام نماییم یک مشکل پیش می آید و آن هم این است که به دلیل این که واکنش های ریل تایم در زمان های مختلف اجرا شده اند ممکن است محدوده Ct برای ژن ها متفاوت باشد. برای اصلاح این مشکل باید در هر دو واکنش ریل تایم علاوه بر نمونه های مورد بررسی باید از یک نمونه مشترک (cDNA) نیز استفاده نمود. برای این نمونه مشترک در هر دو واکنش ریل تایم میزان Ct محاسبه می گردد و سپس با مقایسه اختلاف Ctهای گزارش شده برای این نمونه مشترک بین دو واکنش ریل تایم می توان محدوده Ct همه ژن ها را در دو یا چند واکنش ریل تایم مجزا اصلاح نمود. به این نمونه مشترک در بین واکنش های ریل تایم، نمونه IPC یا کالیبره کننده بین پلیتی (inter plate calibrator) گفته می شود. بنابراین هر پلیت ریل تایم دارای یک نمونه IPC می باشد و منبع cDNA نمونه IPC در همه پلیت های ریل تایم مشترک می باشد. در این مثال به دلیل اینکه ما همه نمونه های ریل تایم اول را در ریل تایم دوم نیز تکرار می نماییم و در واقع همه نمونه ها بین دو پلیت مختلف ریل تایم مشترک هستند، همه نمونه ها یک نوع IPC محسوب می شوند. بنابراین در صورتی که از نمونه IPC در دو ریل تایم استفاده ننموده اید می توانید از داده های یکی از نمونه هایی که دارای بهترین کیفیت Ct در بین نمونه ها می باشد به عنوان IPC استفاده نمایید.
آموزش پردازش داده های ریل تایم که در چند پلیت مجزا (چند واکنش ریل تایم) انجام می شود
در بسیار از موارد به دلایل خاص مانند زیاد بودن نمونه ها، ممکن است بخشی از نمونه ها در یک واکنش ریل تایم و بخش دیگر از نمونه ها در واکنش ریل تایم دیگر انجام گیرد و به این صورت همه نمونه ها (منظور تکرار تکنیکال نیست) در چند واکنش ریل تام سنجش می شوند. همان گونه که قبلا ذکر کردیم هنگامی که میخواهیم داده های دو واکنش مجزای ریل تایم را با یکدیگر ترکیب و آنالیز نماییم یک مشکل پیش می آید و آن هم این است که به دلیل این که واکنش های ریل تایم در زمان های مختلف گذاشته شده اند ممکن است محدوده Ct برای ژن ها متفاوت باشد. برای اصلاح این مشکل در هنگامی که نمونه های در چند واکنش ریل تایم آزمایش می شوند نیز باید از نمونه های IPC استفاده نمود بنابراین در هر واکنش ریل تایم علاوه بر نمونه های مورد بررسی باید از یک نمونه با cDNA مشترک به عنوان نمونه IPC استفاده نمود پس هر پلیت ریل تایم دارای یک نمونه IPC می باشد و منبع cDNA نمونه های IPC در همه پلیت های ریل تایم مشترک می باشد.
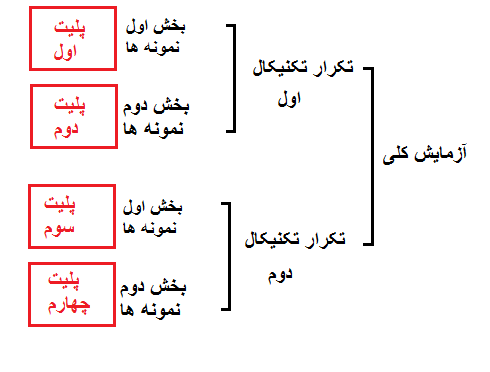
در شکل فوق طراحی یک آزمایش را نشان می دهد که شامل دو دو تکرار تکنیکال می باشد. در هر تکرار تکنیکال بخشی از نمونه ها در یک پلیت و بخشی دیگر در پلیت دوم آزمایش شده اند. بنابراین 4 پلیت در این آزمایش به کار برده شده است.












دیدگاهتان را بنویسید