1-1- توضیح روش ARMs PCR و آموزش تکنیک tetra-ARMS PCR
تکنیک Tetra-ARMs PCR با نام کامل tetra-primer amplification refractory mutation system–polymerase chain یک روش مبتنی بر PCR برای تشخیص وجود پلی مورفیسم های تک نوکلئوتید (SNP) در ژنوم میباشد. قبل از توضیحات بیشتر در مورد تکنیک Tetra-ARMs PCR، در مورد اهمیت و کاربرد شناسایی جهشها در ژنوم توضیحاتی را ارائه میدهیم، زیرا یک از کاربرد بسیار مهم تکنیک Tetra-ARMs PCR تشخیص جهشها میباشد و اصولاً توضیح یک تکنیک بدون توضیح کاربردهای آن، آموزشی ناکامل میباشد. پس در ادامه توضیحاتی در مورد کاربرد شناسایی جهشها در ژنوم ارائه میدهیم و سپس تکنیک Tetra-ARMs PCR را به صورت کامل مورد بحث قرار میدهیم. در توضیحات زیر فقط به کاربرد شناسایی جهشها در ژنوم توجه نمایید نه آموزش تکنیک Tetra-ARMs PCR.
1-2- اهمیت بررسی جهشها در ژنوم
چرا باید جهشها (تغییرات تک نوکلئوتیدی (SNP) و پلی مورفیسم ها در ژنوم) را مورد بررسی قرار دهیم؟ مشخصشده است که ژنوم موجودات به طور طبیعی دارای تفاوتهایی در ردیف بازهای خطی میباشند، این تغییرات طبیعی که سبب گوناگونی در افراد یک جمعیت میشود چند شکلی ژنتیکی (پلی مورفیسم یا جهش) نام دارد. جهشها از طرق مختلفی میتوانند سبب تغییر در فنوتیپ اصلی و بروز صفات جدید مانند بیماری یا سرطان گردند. در این بخش قصد داریم به صورت کاربردی اهمیت شناسایی ارتباط جهشها بروز صفات را توضیح دهیم.
به بررسیهایی که در آنها ارتباط جهشها با بروز یک فنوتیپ خاص مورد بررسی قرار میگیرد، مطالعات همبستگی “association study” میگویند. قبل از توضیح بررسی ارتباط (association ) جهشها با بروز یک صفت خاص، به یک مثال غیر ژنتیکی شناخته شده توجه نمایید: “مصرف سیگار باعث افزایش بروز سرطان ریه میگردد (یعنی مصرف سیگار دارای association با بروز سرطان ریه میباشد)” در این مثال افرادی که سیگار استعمال مینمایند دارای ریسک بالاتری برای ابتلا به سرطان ریه میباشند، پس شناسایی سیگار بهعنوان یکی از ریسک فاکتورهای سرطان ریه دارای اهمیت میباشد. جهشهای ژنتیکی نیز دقیقاً شبیه مثال فوق میباشند، و افرادی که داری یک سری جهشهای خاصی میباشند دارای ریسک بالاتری برای ابتلا به یک فنوتیپ مانند سرطان ریه میباشند. یافتن این جهشها از طریق تکنیک Tetra-ARMs PCR و تعیین سطح خطر افراد دارای این جهشها، موضوع بسیاری از پایاننامهها و طرحهای پژوهشی در کشورمان میباشد. حال چگونه میتوان پی برد که یک جهش با بروز یک صفت مانند سرطان ریه مرتبط میباشد. در مثال ارتباط سیگار با بروز سرطان ریه، ما انتظار داریم که افراد دارای سرطان نسبت به افراد فاقد سرطان، سیگار بیشتری مصرف نمایند به عبارت دیگر درصد افراد سیگاری در افراد سرطانی بیشتر باشد. بنابراین اگر ما 200 فرد مبتلا به سرطان ریه و 200 فرد فاقد سرطان را که به صورت تصادفی انتخاب نماییم و سپس میزان مصرف سیگار را در افراد دو گروه بررسی نماییم و درصد افراد سیگاری در دو گروه را با روشهای آماری موردبررسی قرار دهیم، انتظار داریم که در صد افراد سیگاری در گروه افراد سرطانی بیشتر از افراد غیر سرطانی باشد. همین اصول در طراحی پروژههای ژنتیکی نیز به کار میرود، به این صورت که ابتدا با بررسی مقالات یک جهش که احتمالاً با یک صفت مرتبط میباشد انتخاب میگردد، در مرحله بعد بهصورت تصادفی دو گروه از افراد (یک گروه دارای صفت موردنظر و یک گروه افراد فاقد صفت موردنظر) انتخاب میگردند، در مرحله بعد درصد و فراوانی جهش در دو گروه با تکنیکهایی مانند Tetra-ARMs PCR مشخص میگردد و در مرحله آخر با آزمونهای آماری معنیدار بودن فراوانی جهشها در دو گروه موردبررسی قرار میگیرد. در این کتاب کلیه مراحل فوق را بهصورت دقیق مورد آموزش قرار خواهیم داد.
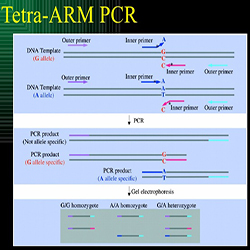
حال که به اهمیت شناسایی جهشها در ژنوم آشنا شدید، تکنیک Tetra-ARMs PCR را که یکی از روشهای شناسایی جهش میباشد موردبررسی قرار میدهیم. قبلاً اشاره نمودیم که تکنیک Tetra-ARMs PCR به معنی تشخیص وجود تغییرات تک نوکلئوتیدی (SNP) و پلی مورفیسم ها در ژنوم بهوسیله روش PCR میباشد و در این روش مهمترین اصل در تفکیک الل دارای جهش و الل فاقد جهش تکثیر شدن و یا عدم تکثیر یک توالی در واکنش PCR میباشد. در واکنش PCR در روش TERTA-ARMs ما از دو پرایمر مخصوص الل موتانت و پرایمر مخصوص الل وحشی استفاده مینماییم. بنابراین تکثیر یک قطعه توسط پرایمر مخصوص الل موتانت به مفهوم وجود جهش در الل میباشد، همچنین تکثیر شدن یک قطعه توسط پرایمر مخصوص الل وحشی به مفهوم عدم وجود جهش در آن توالی میباشد. پس طراحی پرایمر در واکنش Tetra-ARMs PCR بسیار مهم میباشد به شکل بعدی توجه نمایید:
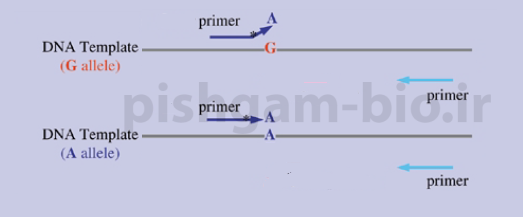
شکل 1: مهمترین نوکلئوتید در پرایمر ها باز انتهای 3پریم آن میباشد، به این صورت که اگر باز انتهای 3پریم یک پرایمر با رشته الگو جفت نشود بنابراین آنزیم پلیمراز قادر به تکثیر آن قطعه نخواهد بود در واکنش PCR محصولی تکثیر نخواهد شد. در شکل فوق الل G (رشته بالا) با باز 3پریم انتهایی پرایمر که A است، جفت نمیشود بنابراین محصولی در PCR تولید نمیشود. اما الل A در PCR تکثیر میشود.
پس اگر ما باز انتهای 3پریم یک پرایمر را برای جهش مورد نظر خود طراحی نماییم، این پرایمر تنها به توالی الگوی حاوی جهش (الل موتانت) متصل خواهد شد و تنها با این توالی واکنش PCR صورت میپذیرد. و به صورت عکس اگر ما باز انتهای 3پریم یک پرایمر را برای توالی فاقد جهش طراحی نماییم، این پرایمر تنها به توالی الگوی حاوی جهش (الل موتانت) متصل خواهد شد و تنها با این توالی واکنش PCR صورت میپذیرد. به شکل شماره 2 توجه نمایید.

شکل 2: در شکل فوق جهش سبب تبدیل باز G به باز T شده است. در واکنش شکل فوق سه پرایمر وجود دارد. یک پرایمر فوروارد که برای هر دو الل موتانت و وحشی مشترک میباشد (هر واکنش PCR حداقل به دو پرایمر نیاز دارد)، یک پرایمر معکوس مختص الل موتانت (جهش یافته) با توالی 3ANNNNNNN5 که در انتهای 3 پریم خود دارای باز A است. بنابراین تنها به الل موتانت متصل خواهد شد (زیرا باز A مکمل باز T میباشد و به باز G متصل نخواهد شد). و یک پرایمر معکوس مختص الل وحشی (الل نرمال) با توالی 3CNNNNNNN5 که در انتهای 3 پریم خود دارای باز C میباشد، بنابراین تنها با الل نرمال که دارای باز G میباشد جفت خواهد شد و توالی الل وحشی تکثیر خواهد شد. حال در شکل فوق اگر یک توالی ناشناخته با پرایمر فوروارد مشترک و پرایمر معکوس مختص الل موتانت در واکنش PCR تکثیر شود بنابراین این توالی دارای جهش در جایگاه مورد نظر میباشد. اما برای اطمینان باید تکثیر شدن این توالی ناشناخته با پرایمر فوروارد مشترک و پرایمر معکوس مختص الل وحشی در واکنش PCR مورد بررسی قرار گیرد، و انتظار این است که این توالی نباید با پرایمر مختص الل وحشی تکثیر شود. به همین صورت میتوان انتظار داشت که توالی فاقد جهش باید با پرایمر معکوس مختص الل وحشی تکثیر گردد و با پرایمر معکوس مختص الل موتانت تکثیر نشود.
پس در شکل فوق برای هر توالی ناشناخته دو واکنش PCR جداگانه لازم است که به تکنیک فوق ARMs-PCR میگویند، روش Tetra-ARMs PCR روش پیشرفتهتر ARMs-PCR میباشد، که در این روش (Tetra-ARMs PCR) طراحی پرایمر ها به گونهای صورت میپذیرد که بتوان دو واکنش PCR با پرایمر مختص الل وحشی و پرایمر مختص الل موتانت را هم زمان در یک واکنش PCR بررسی نمود.
در طراحی پرایمر برای روش Tetra-ARMs PCR ابتدا یک جفت پرایمر عمومی فوروارد و معکوس برای ناحیه دو طرف جهش طراحی مینماییم که اسم این پرایمر ها را پرایمر فوروارد بیرونی (outer forward) و پرایمر معکوس بیرونی (outer reverse) مینامیم. این جفت پرایمر فوق برای هر دو الل مشترک میباشد (شکل 3).
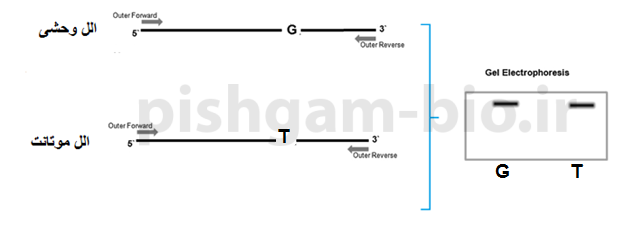
شکل 3: در شکل فوق جهش سبب تبدیل G به T شده است. در طراحی پرایمر برای روش Tetra-ARMs PCR ابتدا یک جفت پرایمر عمومی فوروارد و معکوس برای ناحیه دو طرف جهش طراحی مینماییم که اسم این پرایمرها را پرایمر فوروارد بیرونی (outer forward) و پرایمر معکوس بیرونی (outer reverse) مینامیم. دقت نمایید که در طراحی پرایمرهای فوق جهش مورد بررسی نباید در میان پرایمرها (فاصله مساوی با هر دو پرایمر) قرار بگیرد. به صورتی که اگر فاصله جهش تا پرایمر فوروارد خارجی را A و فاصله جهش تا پرایمر معکوس خارجی را B بنامیم. A تقسیم بر B (یا B تقسیم بر A) بزرگتر از 1.5برابر باشد. وجود این دو پرایمر سبب میشود که ناحیه بین آنها تکثیر گردد، و به دلیل این که این جفت پرایمر برای هر دو الل وحشی و موتانت مشترک هستند، باند حاصل از تکثیر این دو پرایمر باید در همه نمونههای موتانت و وحشی مشاهده گردد و به عنوان یک کنترل برای درست بودن واکنش PCR عمل مینماید. حال باید پرایمرهای اختصاصی الل های موتانت و وحشی طراحی گردند. به صورت توافقی در این آموزش پرایمر مختص الل موتانت به صورت فوروارد (جهت آن از سمت چپ به راست) و پرایمر مختص الل وحشی به صورت معکوس (جهت آن از سمت راست به چپ) طراحی میگردد اما میتوان به صورت برعکس نیز پرایمرها را طراحی نمود (طراحی پرایمر در بخشهای بعدی آموزش داده میشود). به همین دلیل به پرایمر مختص الل وحشی “پرایمر معکوس داخلی” (Reverse inner) و به پرایمر مختص الل موتانت “پرایمر فوروارد داخلی” (forward inner)میگوییم (توجه نمایید که ما در این آموزش به صورت قراردادی این اسامی را برای آموزش آسانتر انتخاب نمودهایم) به شکل شماره 3 توجه نمایید.
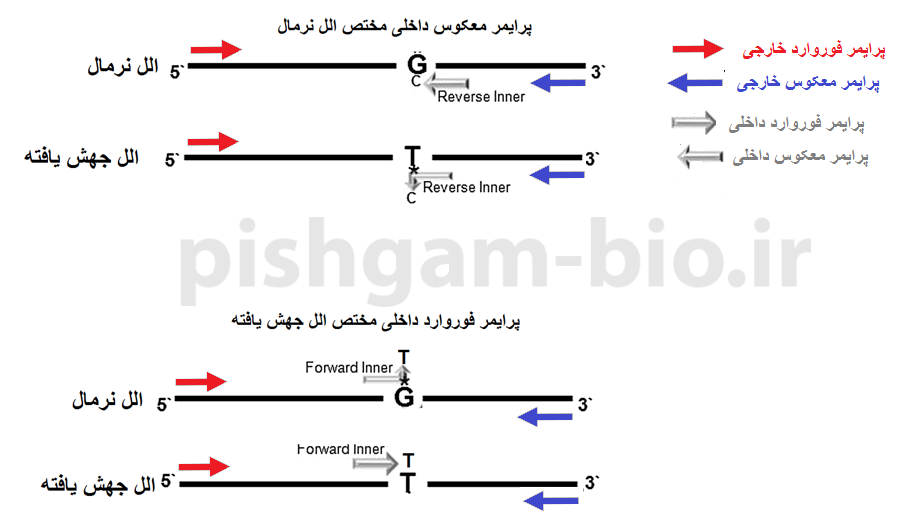
شکل 3: پرایمرهای طراحی شده برای واکنش Tetra-ARMs PCR. در روش Tetra-ARMs PCR از هر 4 پرایمر فوق در یک واکنش PCR استفاده خواهد شد، برای همین اسم این روش Tetra-ARMs PCR میباشد.
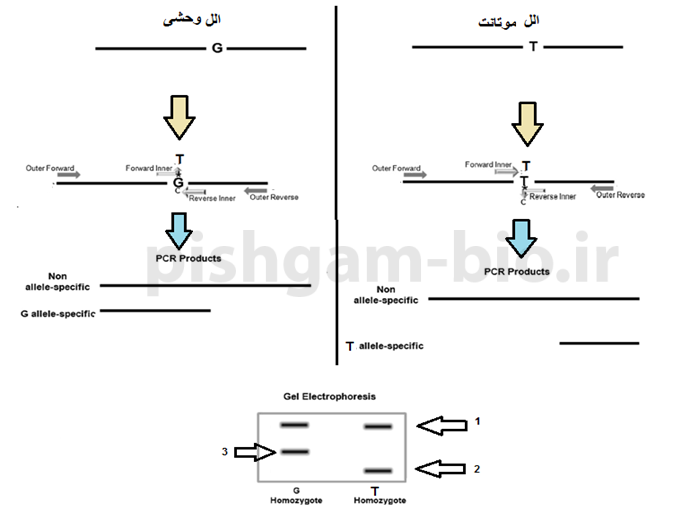
شکل 4: در واکنش PCR با پرایمرهای فوق سه محصول میتوانند تکثر شوند:
محصول اول: محصول حاصل از تکثیر قطعه بین پرایمرهای فوروارد بیرونی (outer forward) و پرایمر معکوس بیرونی (outer reverse). این قطعه تکثیر شده باید در هر دو توالی موتانت و توالی وحشی مشاهده گردد. و همانگونه که قبلاً ذکر شد به عنوان کنترلی برای صحت PCR به کار میرود.
محصول دوم: محصول حاصل از تکثیر قطعه بین پرایمرهای فوروارد بیرونی (outer forward) و پرایمر معکوس درونی (Inner reverse). به دلیل اینکه پرایمر پرایمر معکوس درونی (Inner reverse) تنها به توالی الل وحشی متصل میشود، بنابراین این قطعه تکثیر شده باید تنها در توالی وحشی مشاهده گردد.
محصول سوم: محصول حاصل از تکثیر قطعه بین پرایمرهای فوروارد درونی (inner forward) و پرایمر معکوس بیرونی (outer reverse). به دلیل اینکه پرایمر پرایمر فوروارد درونی (inner forward) تنها به توالی الل موتانت متصل میشود، بنابراین این قطعه تکثیر شده باید تنها در توالی موتانت مشاهده گردد.
محصول اول دارای بیشترین طول میباشد و بعد از آن محصول شماره 3 ( مختص الل وحشی) دارای بیشترین طول و محصول شماره 2 (مختص الل موتانت) نیز دارای کوتاهترین طول قطعه میباشد. پس الل موتانت و وحشی هرکدام دو باند را باید نشان دهند که طول باند کوچکتر با هم متفاوت است.
1-3- شناسایی ژنوتیپ ها بهوسیله روش Tetra-ARMs PCR
در توضیحاتی که در قسمت بالا برای تکنیک Tetra-ARMs PCR ارائه شده برای سادگی کار تنها از یک توالی حاوی جهش و یک توالی فاقد جهش استفاده گردید. در مثالهای فوق توالیهای مثال ارائه شده، بیانگر ژنوم یک موجود هاپلوئید میباشد و در موجودات هاپلوئید برای هر ژن تنها یک نسخه وجود دارد و به عبارتی الل ها بیانگر ژنوتیپ ها میباشند، پس موجودات هاپلوئید دارای یک الل میباشند که این الل میتواند دارای توالی جهش یافته و یا توالی غیر جهش یافته باشد، بنابراین برای موجودات هاپلوئید تنها دو ژنوتیپ داریم:
حالت اول: ژنوتیپ دارای یک الل جهش یافته (موتانت).
حالت دوم: ژنوتیپ دارای الل سالم (وحشی).
اما موجودات دیپلوئید مثل انسان دارای دو الل از هر ژن میباشند پس برای انسان، سه ژنوتیپ (و دو الل) داریم. هر انسانی دارای یکی از سه ژنوتیپ زیر میباشد:
1.حالت اول: ژنوتیپ دارای دو الل جهش یافته (هموزیگوت موتانت).
2. حالت دوم: ژنوتیپ دارای دو الل سالم (هموزیگوت وحشی).
3. حالت سوم: ژنوتیپ دارای یک الل سالم و یک الل جهش یافته (هتروزیگوت).
در شکلهای بعدی نحوه شناسایی ژنوتیپ ها در روش Tetra-ARMs PCR برای موجودات دیپلوئید توضیح داده شده است.
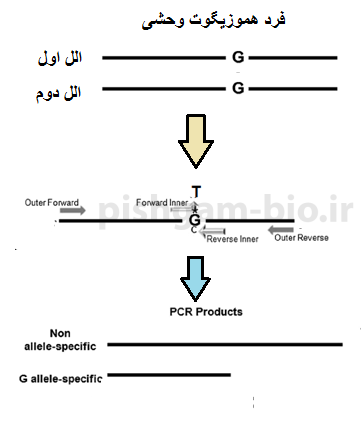
شکل 5: در واکنش PCR با پرایمرهای فوق در فرد هموزیگوت وحشی (که دارای دو الل وحشی میباشد) 2 محصول شماره 1 و شماره 3 تکثیر میشود.
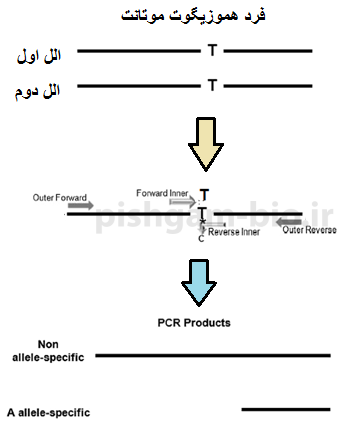
شکل 5: در واکنش PCR با پرایمرهای فوق در فرد هموزیگوت موتانت ( که دارای دو الل موتانت میباشد) 2 محصول شماره 1 و شماره 2تکثیر میشود.
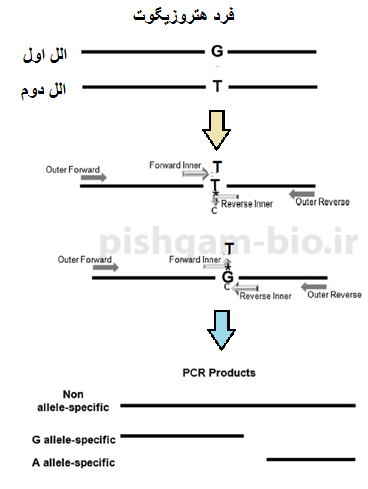
شکل 5: در واکنش PCR با پرایمرهای فوق در فرد هتروزیگوت که دارای یک الل وحشی و یک الل موتانت میباشد 3 محصول تکثیر میشود (شماره 1 و شماره 2 و شماره 3)
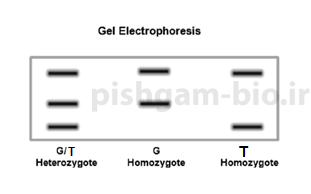
شکل شماره 5: باندهای حاصل از Tetra-ARMs PCR برای ژنوتیپ های مختلف یک موجود دیپلوئید. در این شکل الل جهش یافته تولید باند کوچکتر مینماید.
1-4- مزایای Tetra-ARMs PCR عبارت از موارد زیر میباشد
– تحت تأثیر محیط نیست و صد در صد ژنتیكی است
– هم بارز است (ژنوتیپ هتروزیگوت در آن قابل تشخیص است)
– تکرارپذیری آن بالاست
-هزینه پایین
-عدم نیاز به تکنولوژی بالا
-آنالیز آسان نتایج
1-5- نحوه طراحی یک پروژه بر اساس تکنیک Tetra-ARMs PCR
تا این قسمت مقدمات تکنیک Tetra-ARMs PCR را توضیح دادیم، اکنون برای آموزش کاربردی و پیشرفته این تکنیک، اصول طراحی پک پروژه بر اساس این تکنیک را مطرح مینماییم و به آموزش مراحل آن میپردازیم. اکنون میخواهیم پروژهای را مطرح نماییم که در آن ارتباط یک جهش را با بروز یک فنوتیپ مانند سرطان ریه مورد بررسی قرار دهیم. مراحل اجرای این پروژه بهصورت زیر میباشد:
انتخاب جهش (پلی مورفیسم) مناسب: در این بخش موارد زیر آموزش داده خواهد شد:
نحوه دریافت توالی یک ژن در ناحیه کدینگ، اینترون ها و پروموتر
نحوه شناسایی جهشهای موجود بر روی توالی یک ژن به تفکیک ناحیه کدینگ، اینترون ها و پروموتر
آشنایی با ویژگیهایی که یک جهش را برای بررسی با تکنیک Tetra-ARMs PCR مناسب میسازد.
شناخت جهشهایی که نمیتوان آنها را روش Tetra-ARMs PCR موردبررسی قرارداد.
شناسایی جهشهایی که در محل اتصال فاکتورهای رونویسی پروموتر رخ میدهد.
شناسایی جهشهایی که در محل اتصال و تنظیمی میکروارناها به ژن رخ میدهد.
آموزش اصول طراحی پرایمر اصولی برای تکنیک Tetra-ARMs PCR با نرمافزارهای مختلف
تعیین حجم نمونه مناسب برای بررسی:
آشنایی با محاسبه تعداد نمونه لازم برای بررسی با فرمولهای آماری
آشنایی با تعیین میزان قدرت (power) نمونهگیری در مطالعه
آنالیز دادههای حاصل از Tetra-ARMs PCR در مطالعات همبستگی از طریق نرمافزار SPSS
محاسبه odds ratio، 95%CI و p value بهوسیله رگرسیون لجستیک
محاسبه odds ratio، 95%CI و p value بهوسیله آزمون کای مربع
آنالیز دادههای حاصل از Tetra-ARMs PCR در مطالعات همبستگی از طریق نرمافزار SNP Analyzer 2











دیدگاهتان را بنویسید