آشنایی با روش چند شكلي قطعات DNA حاصل از تكثير تصادفي (RAPD)
در سال 1990 دو گروه تحقيقاتي همزمان روشي را براي سنجش ميزان پلی مورفیسم بدون نیاز به طراحی پرایمر خاص ابداع كردند. يك گروه در شركت Dupont، كه روش خود را RAPD ناميدند(Williams et al. 1993). و گروه ديگر در مؤِسسه تحقيقات زيست شناسي كاليفرنيا (Welsh et al. 1991)كه روش خود را واكنش زنجيره ای پلي مراز با پرايمر تصادفي Arbitrarily Primed PCR ناميدند.
در روش RAPD قطعات زیادی از ژنوم ( 1 تا 20 لوکوس و یا حتی بیشتر ) به طور تصادفی تکثیر میشوند. حضور و عدم حضور این قطعات یا باند ها معیاری برای پلی مورفیسم (چندشکلی) در بین فراد مختلف است. قطعات تکثیر شده بوسیله پرایمر RAPD را میتوان نماینده از کل ژنوم در نظر گرفت، زیرا کوتاه بودن پرایمر ها سبب میشود که در تمام زنوم مکانی برای اتصال یافت شود. Wiliams عنوان کرد قطعات تکثیر یافته در RAPD حاوی ترادف های متعلق به کلاس های مختلف ژنوم (ترادف های تک کپی، تکرار متوسط و تکرار بالا) هستند.
پرایمر های RAPD کوتاه (معمولا10 نوکلئوتی) هستند و حداقل دارای 5 عدد G+C میباشند. برای یک پرایمر 10 تایی تصادفی در حدود 1048576 ترکیب میتوان در نظر گرفت اما به دلیل اینکه این قطعات باید حاوی 60 تا 70 درصد G+C باشند اذا تعداد ترکیبات ممکن به شدت کاهش خواهد اشت و در حدود 24576 ترکیب خواهد بود(Harris, 1999).
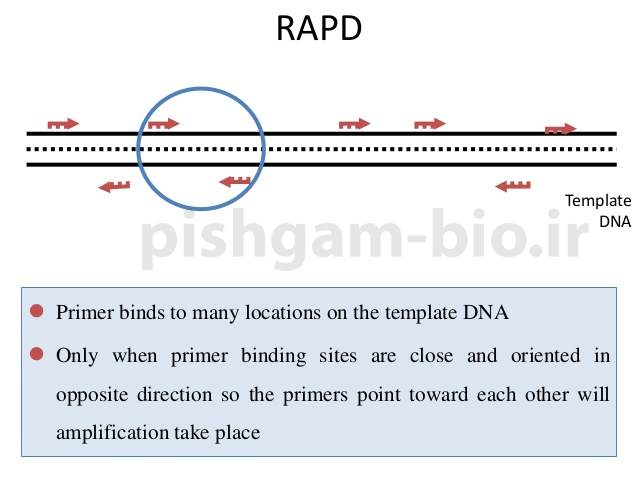
دلیل پليمورفيسمی که در تكنيك RAPD مشاهده میشود را میتوان به دليل تفاوت در محل اتصال پرايمرها (جهشهاي نقطهاي) و يا بازآرايي در داخل قطعات تكثيريافته (حذف، واژگوني و دخول) نسبت داد (Williams et al. 1993). قطعاتی که بوسیله پرایمرهای RAPD تكثيرمی یابند بر طبق مندل تفرق مييابند بنابراين ميتوان از آنها بعنوان نشانگرهاي ژنتيكي استفاده کرد (عبدميشاني، 1376).
پرایمرهای RAPD به دلیل طول کوتاه خود دارای دمای اتصال پایینی میباشند برای این پرایمر ها معمولا دمای 36 درجه برای دمای اتصال به کار میرود، دماهای بالاتر سبب کاهش میزان قطعات تکثیر شده میگردد.
برخی موارد باند های ثکثیر شده در تكنيك RAPDداراي شدت [1] (وضوح) متفاوتي ميباشند. اين امر ميتواند به دليل تفاوت در تعداد الگوي باندها و يا ناشي از هموزيگوت يا هتروزيگوت بودن در لوكوس مورد نظر باشد. همچنين غلظت Mg+2 و دماي اتصال پرايمر را نیز میتوان از جمله عواملي دانست كه تأثير زيادي بر روي وضوح باندها ميگذارند ولي غلظت پرايمر بر روي وضوح باندها اثر کمی دارد (Williams et al. 1993). تكنيك RAPD به شرايط واكنش بسيار حساس است و هر تغيير كوچك در يكي از فاكتورها سبب تغيير نتايج ميشود. به طوريكه نشان داده شده كه حتي انواع مختلف DNA پليمراز، الگوي باندي متفاوتي را توليد ميكنند. به همين علت ثابت نگهداشتن شرايط واكنش براي تكرارپذيري نتايج ضروري ميباشد.
همچنين بيثباتي باندهاي RAPD ميتواند به علت جفت شدن ناجور پرايمر و الگو در غلظتهاي تحت مطالعه Mg+2 باشد. بنابراين اگر غلظت Mg+2 كنترل نشود ممكن است منجر به كاهش باندها و يا توليد پليمورفيسم دروغين[2] در الگوي باندها باشد.
میزان DNA الگو در این تکنیک دارای اهمیت فراوان میباشدو کم یا زیاد شدن آن بروی تعداد باندهای تولید شده و وضوح آن ها تاثیر میگزارد. مقادیر بالای DNA سبب ایجاد باند های ناواضح و اسمیر[3] میشود و مقادیر کم DNA الگو سبب عدم تکرار پذیری و ایجاد باند های ناواضح میشود. . این امر میتواند به دلیل شکست در مناطق الگوی مربوط به آن باندها و یا به دلیل کم بودن تعدا کپی DNA الگو باشد که منجر به قابل تشخیص نبودن محصول میشود. (Wiliams et al ., 1993).
در بعضي موارد در الگوي قطعات تكثير يافته باندهاي ناواضحي ديده ميشود كه ممكن است به دليل تشخيص اشتباه پرايمر بين مناطقي از ژنوم كه تفاوت نوكلئوتيدي آنها كم است باشد. اين امر ميتواند منجر به بيثباتي باندها و عدم تكرارپذيري شود(Williams et al., 1993).
همچنين بيثباتي باندهاي RAPD ميتواند به علت جفت شدن ناجور پرايمر و الگو در غلظتهاي تحت مطالعه Mg+2باشد. بنابراين اگر غلظت Mg+2 كنترل نشود ممكن است منجر به كاهش باندها و يا توليد پليمورفيسم دروغين[4] در الگوي باندها باشد. همچنین یک قطعه میتواند در یک غلظت خاصی از Mg++ پلی مورف و در غلظت دیگر مونومورف باشد. میزان بهینه یون Mg+2 برای اکثر پرایمر ها در محدوده 5/4 الی5/1 میلی مولار میباشد. پیشنهاد میشود که غلظت مناسب Mg++ برای هر پرایمر باید به طور جداگانه تعیین شود تا حداکثر پایداری در محصولات و همچنین حداکثر پلی مورفیسم بدست آید. (Park and Kohel. , 1994).
در تکنیک RAPD فرض بر آن است که باند هایی که بر روی ژل در کنار یکدیگر قرار دارند دارای همولوژی و از یک لوکوس خاص باشند. اين مشكل را ميتوان توسط سيستمهاي دقيقتر تفكيك قطعات و پيبردن به ويژگيهاي هر محصول از طريق آناليزهاي ژنتيكي و تركيبي از كلهگذاري سادرن و مطالعات هضم آنزيمي برطرف نمود(Harris. 1999).
مزایای استفاده از نشانگر (مارکر) RAPD
نشانگرهای RAPD دارای مزایای ویژهای دربرابر سایر نشانگر ها میباشند که میتوان به نکات زیر اشاره کرد
1- هزینه کمتر نسبت به سایر تکنیک ها: در این تکنیک پرایمر نیاز به طراحی خاص ندارد و کوتاه بودن طول آن هزینه کمتر ساخت ان میشود همچنین برای انالیز محصولات میتوان از ژل آکارز استفاده نمود، که کار کردن با آن بسیار ساده و سریع میباشد.
2- عدم نیاز به مقدار زیاد DNA الگو
3- امکان بررسی گونه های مختلف با پرایمر های یکسان
4- عدم نیاز به کاوشگر ، مواد رادیو اکتیو و ….
5- سرعت نسبتا زیاد برای بررسی تعداد زیادی نمونه
6-امکان بررسی همزمان چندین جایگاه ژنی در ژنوم نمونه ها
7-عدم نیاز به اطلاعات اولیه در مورد ردیف DNA جهت طراحی و ساخت پرایمر
8-نمونه برداری تصادفی از بسیاری از جایگاه های ژنی
اکثر مزیت های فوق به دلیل ساختار پرایمر میباشدکه سبب میشود این پرایمر ها در ژنوم های مختلف جایگاهی برای اتصال داشته باشد.
مشکلات تکنیک RAPD در بررسی تنوع ژنتیکی و روابط فیلوژنی
عدم تکرار پذیری
تکرار پذیری پایین در تکنیک RAPD دارای دلایل مختلفی از جمله: غلظت پرایمر ، منبع DNAپلیمراز ، غلظت یون منیزیم ، دستگاه ترموسایکلر وبرنامه دمایی PCR میباشد، و یکی از عمده ترین مشکلات این تکنیک ذکر میشود. اين مشكل سبب سئوال برانگيز بودن ارزش نشانگرهاي RAPD ميشود. البته اين مشكل در مواردي كه از نشانگرهاي RAPD براي بررسي تنوع استفاده ميشود، خيلي مهم نيست. اما اگر از اين نشانگرها براي تعيين حد و مرز بين گونهها و يا شناسايي نشانگرهاي اختصاصي براي مطالعات Introgression و يا هيبريداسيون استفاده شود مسئله مهمي خواهد بود(Harris. 1999).
برای حل این مشکل میتوان تهیه مخلوط PCR در شرایط استاندارد و بهینه سازی و یکنواخت کردن کلیه فاکتورها برای انجام دقیق آزمایش را پیشنهاد داد. در روش که توسط Taguchi در سال 1986 ارائه شد میتوان از دماي اتصال بالا (معمولاً 48 درجه سانتيگراد) و غلظت بيشتر پرايمر (معمولاً M µ 8) نیز استفاده ميشود(Cobb and Clarkson. 1994). هر چند استفاده از دمای اتصال بالا تاثیر بسزایی در تکرا پذیر بودن و افزایش باندهای تخصصی خواهد داشت اما در عین حال سبب کاهش تعداد باند ها و در بعضی از مواقع سبب عدم تکثیر در RAPD میشود.
یکی از مهمترین متغییر ها در RAPD نسبت غلظت پرایمر به الگو میباشد. این نسبت از فاکتورهایی است که سختی واکنش را تعیین میکند (Bassam et al., 1992). هر قدر این نسبت بیشتر باشد الگوهای تولید شده در واکنش تکثیر پیچیده تر و پایدارتر خواهند بود. به همین علت در بعضی از آزمایشها اقدام به افزایش غلظت پرایمر در واکنش میکنند (Caetano-Anolles, 2005).
غالب بودن
غالب بودن نشانگرهاي RAPD به آن معنا است كه فراواني اللها را نميتوان محاسبه نمود. زيرا افراد هتروزيگوت از هموزيگوت قابل تشخيص نيستند، اطلاعات تجربی محققان نشان میدهد که حداقل 95 درصد محصولات RAPD بصورت نشانگر های غالب عمل میکنند. (Wolff and Morgan- Richards. 1999).
با روش دانسسیتومتری میتوان باند ها را از نظر کمی بررسی نمود، بدین صورت که شدت باند ها در هتروزیگوت نصف هموزیگوت ها خواهد بود. البته صحت این روش 100 در صد نیست و باید با روشهای دیگر مثل RFLP تایید شود (Wiliams et al ., 1993). همچنین میتوان از 2 نشانگر RAPD که پیوستگی بالایی با هم دارند و هر کدام در یکی از والدین تکثیر مییابد، استفاده نمود. در این حالت تکثیر هر دو نشانگر در نتایج، بیانگر هتروزیگوت بودن آن مناطق است.
همولوژی
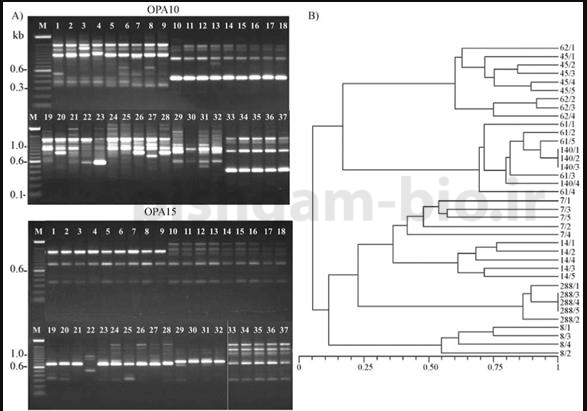
در بررسي قطعات تكثير يافته در RAPD قطعاتي كه بر روي ژل در روی یک خط باا ندازه یکسان قرار دارد از یک لوکوس میدانند و آن ها داراي همولوژي ميباشند. اما محصولات هم اندازه به دلايلي ممكن است از چند لوکوس مختلف باشند، از جمله محدوديت قدرت تفكيك ژل و يا يكسان بودن اندازه قطعات بدون يكسان بودن تواليها (Harris,1999) . اين اشتباه به خصوص در پرايمرهايي كه تعداد باندهاي بيشتري توليد ميكنند، احتمال بيشتري دارد(Schierwater,1995).
این مشکل را میتوان توسط سیستم های دقیق تر تفکیک قطعات و پی بردن به ویژگیهای هر محصول از طریق آنالیز های ژنتیکی و ترکیبی از لکه گذاری سادرن و مطالعات هضم آنزیمی بر طرف نمود(Harris , 1999).
در تحقیقی نشان داده شده که 91 درصد از 220 قطعه دارای اندازه یکسان همولوگ میباشند. این امر بیانگر آن است که اندازه محصول میتواند بعنوان ملاکی برای همولوژی مورد استفاده قرار گیرد (Rieseberg, 1996).
باندها غیر والدینی
وجود باندهايي در زاده ها كه در والدين آنها حضور ندارد را از ديگر مشكلات RAPD ذکر میکنند این باند ها را باندهای غیر والدینی میگویند(Ayliffe et al. 1994). علت ايجاد باندهاي غيروالديني تشكيل هترودابلكس بين دو رشته داراي همولوژي بالا (ولي نه كاملاً يكسان) تشكيل میباشدبه طوری که هترودابلكس ميتواند بين فرمهاي اللي در واكنش PCR، تشكيل شود. در اين صورت اين باندها فقط در افراد هتروزيگوت از نظر لوكوس مورد نظر مشاهده ميشوند. برای اثبات این موضوع میتوان DNA دو والد را كه هركدام از نظر يكي از اللها هموزيگوت باشند به نسبت مساوي مخلوط نمود و با پرایمر مورد نظر مورد بررسی قرار داد. در محصولات PCR علاوه بر تشكيل باندهاي مربوطي به دو الل لوكوس مورد نظر، باند سومي كه داراي همولوژي بسيار بالا با دو الل ديگر ميباشد نيز تشكيل ميشود. اين باند سوم در نتيجه تشكيل هترودابلكس بين دو الل اصلي بوجود ميآيد(Wu et al. 2002).
البته احتمال تشکیل هترودابلکس و وجود هم بارزی در تعداد ناچیزی از واکنش های RAPD رخ میدهد. در یک تحقیق میزان تشکیل هترودابلکس 2/0 درصد گزارش شد (Hallden et al., 1996). این میزان پائین در مطالعات دیگر هم نشان داده شده است (Hunt and Page , 1992 Ayiffe et al., 1994).
رقابت
منظور از رقابت، رقابت بين مناطق مختلف اتصال پرايمر در ژنوم میباشد. مشاهدات زيادي نشان داده كه نتايج نهايي RAPD، از رقابت بين این مناطق حاصل ميشود. به بیان ساده ترتكثير ممكن است از مناطق زيادي شروع شود ولي در نهايت فقط تعدادي از آنها به عنوان باندهاي واضح قابل تشخيص هستند(Halldea et al., 1996). رقابت در بین محصولات PCR از موضوعات مهم و قابل بررسی است. این رقابت میتواند در سطوح مختلفی بین نواحی داخل یک ژنوم و بین ژنوم ها روی میدهد (Heun and Helentjaris, 1993).
Hallden و همکاران در سال 1996 نشان دادند که رقابت محصولات RAPD، یک منبع خطای مهم در ژنوتیپ بندی[5] براسیکا میباشد و میتوانند منجر به عدم برآورد صحیح روابط ژنتیکی شود.
یکی از فاکتورهای تعیین کننده در رقابت، پایداری هیبرید تشکیل شده بین پرایمر و مناطق اتصال در DNA هدف میباشد، یک ژنوم با پیچیدگی بالا دارای مناطق بیشتری از جفت شدگی بهتر با پرایمر در مقایسه با ژنوم با پیچیدگی پائین است (Wiliams et al ., 1993).
نمونه برداری از کل ژنوم
به دلیل عدم اختصاصی بودن پرایمر ها در RAPD از نظر تئوری قطعات تکثیر یافته در این واکنش، از کل ژنوم گیاه شامل : هسته، متوکندری و کلروپلاست حاصل میشوند. از آنجائیکه نرخ تکامل و نوع وراثت در مورد ارگانل ها و هسته متفاوت است، این امر در بررسی ساختار ژنتیک جمعیت میتواند مشکل ایجاد کند.
در تحقیقی که بر روی گیاه براسیکا انجام گرفت، نشان داده شد که هم ژنوم میتوکندری و هم کلروپلاست در ایجاد پروفایل های RAPD نقش دارند و در این میان نقش میتوکندری بیشتر است .(Thorman et al., 1994) مطالعه Aagaard و همکاران هم موید آن بود که 45% محصولات RAPD منشاء میتوکندریایی دارند (Aagaard et al.,1995).
ساخت پرایمر برای تکنیک RAPD
پرایمرهای RAPD دارای میزان بالایی بالای CG در ترکیب خود هستند که اتصال پرایمر را در دمای پایین به مکان اختصاصی خود تسهیل میکنند (Welsh and McClelland, 1994).
با توجه به اینکه محتوای CG در ژنوم بطور یکسان توزیع نشده، بنابراین در روش RAPD امکان دارد پرایمر ها به مناطقی که غنی از GC متصل شوند و این نواحی بیشتر تکثیر شوند (Harris, 1995). همچنین عنوان شده است که پلی مورفسیم بالای مناطق CpG (مناطق متیلاسیون در ژنوم های یوکاریوتی) ممکن است سبب تخمین بیش از حد واقعیت در تاکسون های بسیار نزدیک به هم شود (Clark and Lanigan, 1993).
آموزش کاربرد روش RAPD
نشانگر های RAPD کاربرد فراوانی دارند که از جمله میتوان به بررسی تنوع ژنتیکی، بررسی ژنتیکی جمعیت، فیلوژنتیک، تهیه نقشه ها ژنتیکی، تعیین پیوستگی با صفات مطلوب بررسی جایگاههای ژنی کنترل کننده صفات کمی، طبقه بندی لاین ها از نظر توانایی تولید هیبرید های مختلف، بررسی پدیده Introgression، شناسایی ارقام و انگشت نگاری DNA اشاره کرد.
کاربرد روش و تکنیک RAPD در سیستماتیک مولکولی
از نشانگرهاي RAPD ميتوان براي شناسايي تاكسون هاي مختلف در سطح جمعيت تا جنس استفاده كرد . این نشانگر تنوع بالایی را در بین و داخل گونه ها نشان میدهد، بنابر این برای آنالیزهاا فیلوژی و تعیین قرابت بسیار مناسب میباشد. براي هر تاكسون بايد تعداد زياد وكافي از ژنوتيپ ها را بررسي كرد تا مطمئن شويم كه يك نشانگر در همه ژنوتيپ ها وجود دارد و ناشي از فراواني اللي نيست. از طرفي به علت اينكه اين نشانگرها در رنج تاكسونوميكي محدودي قابل استفاده هستند استفاده از آنها در فيلوژني محدود ميباشد(Scherwater. 1995)
شناخت نقشه های ژنتیکی با استفاده از نشانگرهای RAPD
در گونه های درختی که اطلاعات چندانی از ژنوم و توالی های آنها در دسترس نیست، میتوان از نشانگر های RAPD بعنوان اولین انتخاب برای تهیه نقشه های ژنتیکی نشانگرهای RAPD استفاده نمود(Grattapaglia and Sederoff, 1994). همچنین برای اشباع نقشه ژنتیکی در منطقه ای که حاوی نشانگر های پراکنده RFLP است، توانایی بالایی دارند. همچنین در صورتیکه نشانگر های RAPD فاقد ترادف های تکراری باشند میتوان از آنها برای جدا کردن و کلون کردن ژنهایی که وظایفشان یکسان نیست استفاده نمود (Paran et al ., 993).
Michelmore و همکاران از نشانگرهای RAPD و روشهای آنالیز تفکیک گروهی برای شناسایی نشانگر های پیوسته به ژنهای مقاومت به بیماری Downy milew در Lactuca استفاده کردند و توانستند کلیه نشانگر های نزدیکتر از cM15 را مشخص کنند. همچنین با استفاده از تکنیک RAPD و روش آنالیز تفکیک گروهی [6](BSA) نشانگر های پیوسته به ژنهای زیادی در برنج شناسایی شده اند. در آزمایشاتی که توسط Wu و همکاران انجام گرفت دو نشانگر هم بارز RAPD که با ژن bc-1 پیوستگی داشتند و 6 نشانگر هم بارز دیگر که با ژن la پیوستگی داشتند، شناسایی شدند. از این نشانگر ها میتوان برای کلون کردن ژنها بر اساس موقعیت شان بر روی نقشه استفاده کرد (Wu et al., 2002)
بررسی تنوع ژنتیکی با استفاده از مارکرهای RAPD
تا کنون از تکنیک RAPD برای بررسی میزان تنوع در بسیاری از جمعیت ها ، ارقام و گونه ها به کار رفته است دلیل این امر را میتوان در کارامد بودن ، کم هزینه و سریع بودن این روش یافت. گروهی از محققان نشان دادند که نشانگر های RAPD و RFLP دارای قدرت یکسانی در جداسازی و تفکیک ژنوتیپ های B.napus هستند. لذا پیشنهاد دادند که با توجه به سهولت استفاده از نشانگر RAPD، استفاده از آن ها بخصوص در لاین های زراعی اصلاح شده که دارای خویشاوندی های نزدیک میباشند، ارجحیت دارند (Hallden, 1994).
همچنین این تکنیک در تفکیک ارقام انار باغی، وحشی و زینتی از یکدیگر بسیار موئر واقع گردیده است كه از آن جمله ميتوان به تحقيقات Sarkhosh و همكاران (2006)، Sheidai و همکاران (2007)، Ercisli و همکاران (2007)، Narzary و همکاران (2009) اشاره نمود. همچنين در تحقيقي كه توسط Kunwar وهمکاران (2008) انجام پذيرفته، توانايي ماركرهاي مولكولي RAPD در تمايز ارقام اهلي و وحشي انار نشان داده شده است.
انتخاب به کمک نشانگر ها[7]
باندهای اختصاصی که در گونه، رقم یا جمعیت مقاوم و دارای یک صفت خاص وجود دارد را میتوان برای دست یابی به لوکوس مسئول این ویژگی خاص مورد بررسی قرار داد. به عنوان مثال با بررسی باند های حاصل از 260 پرایمر RAPD در ارقام برنج، یکی از باندها فقط در گیاهان فاقد ژن مقاومت Bacterial blight به نام xa-13 وجود داشت. با بررسی های بعدی فاصله این نشانگر تا ژن مورد نظر cM3/5 تعیین شد با استفاده از نشانگر های پیوسته به این ژن از جمله نشانگر فوق، میتوان از روش انتخاب به کمک نشانگر در بهنژادی برنج استفاده کرد (Zhang et al ., 1996) .
در سال 1995 یک گروه تحقیقاتی همبستگی بین نشانگر های RAPD و میزان غلظت اسید لینولنیک در کلزا را مورد بررسی قرار دادند. در این مطالعه از 34 پرایمر RAPD در میان 64 بوته استفاده شد. با توجه به تجزیه واریانس بعمل آمده یک نشانگر RAPD بطور معنی داری با محتوای اسید چرب لینولنیک پیوسته بود. این نشانگر جهت تسهیل در گزینش بذرهای کلزا از نظر ترکیبات اسیدهای چرب مفید و قابل استفاده میباشد(Tanhuanpaa et al ., 1995).
آموزش نحوه ارزش گذاري محصولات و باندهای حاصل از RAPD
در RAPD ارزش گذاری محصولات بر اساس حضور و یا عدم حضور باندها صورت میگیرد.در این روش جایگاه ژنی که شامل ترکیبات آللی مختلفی است بعنوان صفت در نظر گرفته میشود. و وجود یک باند به معنی وجود این جایگاه ژنی میباشد. اگر چه شواهدی مبنی بر چند آللی بودن RAPD وجود دارد ولی در بررسی ژنتیک جمعیت لوکوس های RAPD بصورت دو آللی درنظر گرفته میشوند. از انجایی که روش ساده ای برای شناسایی آلل ها و ترکیبات آنها وجود ندارند، مدل آلل بعنوان صفت برای بررسی داده های RAPD مناسب نیست (Harris, 1999).
برای ارزش گذاری دقیق تر پروفایل های RAPD بهتر است نکات زیر در نظر گرفته شود:
1- محصولات تنها در یک محدوده مشخصی از نظر اندازه ارزش گذاری شوند.
2- تنها محصولاتی که شدت ( وضوح) بالایی دارند و سیگنال های قوی تولید کرده اند، ارزش گذاری شوند زیرا این محصولات در مقایسه با محصولات دارای وضوح کمتر، تکرار پذیری بیشتری را نشان میدهند.
3- محصولات در یک واکنش ناحیه بین قطعات مونومورف بزرگ و کوچک ارزش گذاری شوند، بطوریکه کیفیت یک واکنش تکثیر را بتوان تعیین نمود (Staub et al ., 1996).
این روش اگرچه سبب کاهش تعداد قطعات ارزش گذاری شده میشود، اما اطمینان از صحت ارزش گذاری را افزایش میدهد. از عوامل دیگری که سبب افزایش اطمینان به داده ها میشوند میتوان به استخراج مجدد DNA و عدم وجود آلودگی اشاره نمود.